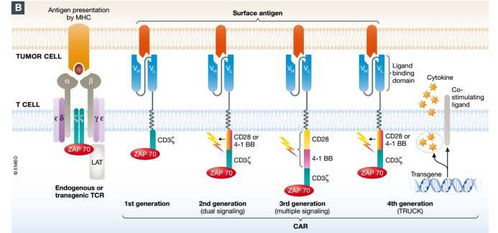
嵌合抗原受体T细胞(CAR-T)疗法作为肿瘤免疫治疗领域的一项革命性突破,已从实验室研究迅速走向临床应用,为血液系统恶性肿瘤患者带来了前所未有的治愈希望。这一开创性疗法的发展历程,既充满了激动人心的机遇,也面临着严峻的科学与临床挑战,其未来的成熟与普及,高度依赖于持续深入的工程、技术研究与试验发展。
一、 历史性机遇:从概念验证到临床转化
CAR-T疗法的核心机遇在于其能够“重新编程”患者自身的免疫细胞,使其具备精准识别并高效清除肿瘤细胞的能力。自2017年首款CAR-T产品获美国FDA批准以来,该疗法已在复发/难治性B细胞淋巴瘤、白血病等疾病中展现出卓越的疗效,部分患者甚至达到长期完全缓解,实现了从“绝症”到“可治”的范式转变。这不仅是肿瘤治疗领域的里程碑,更开辟了个体化、活细胞药物这一全新赛道,吸引了全球学术界和产业界的巨额投入与高度关注。
二、 当前面临的临床挑战
尽管前景广阔,CAR-T疗法的临床推广仍面临多重瓶颈:
- 安全性风险:细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)是常见且可能危及生命的严重不良反应,其发生机制与预测模型仍需深入研究。
- 实体瘤疗效有限:相较于血液瘤,CAR-T在实体瘤治疗中效果不佳,面临肿瘤微环境抑制、靶抗原异质性、细胞浸润困难等“壁垒”。
- 可及性与成本:自体CAR-T疗法制备流程复杂、周期长、成本极其高昂,限制了其惠及更广泛的患者群体。
- 耐药与复发:部分患者会出现靶抗原丢失或T细胞功能耗竭,导致治疗无效或疾病复发。
三、 工程与技术创新:破局的关键路径
应对上述挑战,未来的发展重心必须置于跨学科的工程与技术研究与试验发展(R&D)上:
- 新一代CAR结构工程:研发包含共刺激域、安全开关、逻辑门控(如“与”门)的智能型CAR,以提升特异性、持久性并降低脱靶毒性。
- 通用型(“现货型”)CAR-T技术:通过基因编辑技术(如CRISPR/Cas9)敲除宿主T细胞的排斥相关基因,开发源自健康供体的同种异体CAR-T产品,旨在实现标准化、规模化生产,降低成本与等待时间。
- 实体瘤微环境改造策略:结合CAR-T与免疫调节剂、溶瘤病毒或靶向肿瘤基质的疗法,改造免疫抑制性微环境,增强T细胞浸润与功能。
- 先进制造与自动化工艺:开发封闭式、自动化的细胞生产系统,优化载体转导效率,建立严格的质量控制体系,是确保产品一致性、安全性与可扩展性的工程基础。
- 新型递送与基因编辑技术:探索非病毒载体(如转座子/转座酶系统)进行基因递送,以及更精准、高效的体内基因编辑技术,为实现体内直接制备CAR-T细胞提供可能。
四、 展望未来
CAR-T疗法的故事远未结束,它正从一个针对特定血液瘤的“特效药”,向着一个可编程、可调控的通用型细胞治疗平台演进。这一进程的成功,有赖于生命科学家、临床医生、生物工程师、数据科学家和监管机构的紧密协作。通过持续的基础研究厘清作用机制,通过巧妙的工程学设计优化产品性能,并通过严谨的临床试验验证安全有效,我们才能逐步攻克现有难题,解锁CAR-T疗法在更广泛疾病领域(包括自身免疫性疾病、慢性感染等)的应用潜力,最终将这种“活的药物”转化为惠及全球患者的常规治疗选择。机遇与挑战并存,正是技术创新驱动医学进步的生动写照。